Модель бутана из пластилина: Молекулы из пластилина. Пошаговый урок лепки. – Практическое занятие по теме «Изготовление моделей молекул органических веществ»
Поурочный план лабораторной работы по теме: «Изготовление моделей молекул углеводородов»
Составить шаростержневую модель молекулы метана:
— сделать из черного пластилина один шарик, который будет символизировать атом углерода, и из белого пластилина сделать четыре шарика, которые будут символизировать атомы водорода. Причем диаметр черного шарика должен превышать диаметр белых шариков в 1,5 раза.
— на черном шарике (атом углерода) наметьте четыре равноудаленные друг от друга точки и вставьте в них палочки, к концам палочек присоедините четыре белых шарика (атомы водорода).
Составить шаростержневую модель молекулы трихлорметана:
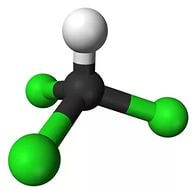
— исходя из модели молекулы метана, составьте модель молекулы трихлорметана.
— сделать из синего пластилина три шарика, которые будут символизировать атом хлора. Причем диаметр синих шариков должен превышать диаметр белых шариков в 2 раза.
— отнимите от модели молекулы метана три шарика белого цвета (символ атома водорода) и на освободившиеся места прикрепите синие шарики (символ атома хлора).
Составить шаростержневую модель молекулы этана:
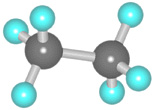
— сделать из черного пластилина два шарика, которые будут символизировать атом углерода, и из белого пластилина сделать шесть шариков, которые будут символизировать атомы водорода. Причем диаметр черных шариков должен превышать диаметр белых шариков в 1,5 раза.
— соедините между собой палочкой шарики черного цвета.
— на каждом черном шарике (атом углерода) наметьте три равноудаленные друг от друга точки и вставьте в них палочки, к концам палочек присоедините белый шарик (атомы водорода).
Составить шаростержневую модель молекулы хлорэтана:
— исходя из модели молекулы этана, составьте модель молекулы хлорэтана.
— сделать из синего пластилина шарик, которые будут символизировать атом хлора. Причем диаметр синего шарика должен превышать диаметр белых шариков в 2 раза.
— отнимите от модели молекулы этана один шарик белого цвета (символ атома водорода) и на освободившееся место прикрепите синий шарик (символ атома хлора).
Составить шаростержневую модель молекулы бутана:

— сделать из черного пластилина четыре шарика, которые будут символизировать атом углерода, и из белого пластилина сделать десять шариков, которые будут символизировать атомы водорода. Причем диаметр черных шариков должен превышать диаметр белых шариков в 1,5 раза.
— соедините между собой палочками шарики черного цвета.
— на первый и четвертый черный шарик (атом углерода) наметьте три равноудаленные друг от друга точки и вставьте в них палочки, к концам палочек присоедините белый шарик (атомы водорода). Ко второму и третьему черному шарику вставить по две палочки, к концам палочек присоедините белый шарик (атомы водорода).
Выводы по лабораторной работе: _______________________________________________________.
Контрольные вопросы по защите лабораторной работе:
Какие существуют способы моделирования молекул органических соединений?
Какие положения теории химического строения органических соединений учитывались при составлении моделей молекул углеводородов?
Записать название соединений их структурные формулы. С6Н14, С7Н16. Составить изомеры этих соединений, назвать их.
Инструкция к практической работе: «Изготовление моделей углеводородов»
Инструкция к практическая работе: «Изготовление моделей молекул углеводородов».
Цель работы: научиться составлять модели молекул углеводородов, записывать сокращённые структурные формулы и называть их по международной номенклатуре, составлять структурные формулы углеводородов по названию.
Оборудование; шарики из пластилина, имитирующие атомы углерода и водорода, спички, инструкции к работе, дощечки для работы с пластилином.
Инструктаж по технике безопасности.
1.Работать строго по инструкции.
2.Пластилиновые шарики и спички использовать только для составления моделей углеводородов.
3.Модели собирать над дощечкой для работы с пластилином.
5.После проверки учителем изготовленных моделей молекул, модели разобрать, шарики и спички положить в соответствующие коробочки и сдать лаборанту.
6.Вымыть руки с мылом.
7.Приступить к выполнению теоретического задания в тетрадях для практических работ.
Указание к работе. Работа выполняется по вариантам. Задание 1 общее для 1 и 2 вариантов. Учащиеся работают в парах.
Задание 1. Соберите модели молекул метана, пропана, бутана.
Что общего в строении молекул этих веществ, в чем различие? Чем объясняется зигзагообразное строение углеродной цепи в молекулах пропана и бутана? Какова величина угла в зигзагообразном отрезке углеродной цепи? Продемонстрируйте на моделях молекул этана и пропана возможность свободного вращения углеводородных радикалов относительно друг друга (конформация) и образования в результате этого огромного числа пространственных изомеров. Почему нельзя выделить эти изомеры? Как называется химическая связь, образованная в результате перекрывания электронных облаков вдоль линии, связывающей центры атомов?
Выполнение опыта.
1. Возьмите шарик, который условно будет изображать атом углерода, и четыре стержня (или спички), которые будут изображать связи С—Н. Объясните, почему химические связи располагаются вокруг атома углерода под углом 109°28′ относительно друг друга. Расположите четыре стержня под указанным углом между ними.
2. Мысленно или при помощи нити соедините центры ядер атомов водорода (свободные концы стержней) друг с другом. Изображение какой геометрической фигуры вы получили?
3. На свободные концы стержней прикрепите (наколите) четыре шарика. Такая модель молекулы метана называется шаростержневой моделью.
Аналогичные модели молекул, в которой детали, изображающие атомы элементов, выполняются в соответствующем масштабе, называются масштабными.
Вариант 1
Задание 2.Соберите модель молекулы С3Н6. Сколько спичек вы расположили между атомами углерода? Как называется эта связь? К какому классу соединений принадлежит этот углеводород? Какой тип гибридизации атомов углерода? Валентный угол? Возможно ли свободное вращение атомов при двойной связи? Запишите общую формулу углеводородов этого класса. Какие виды изомерии характерны для них?
Задание 3.Назовите вещества
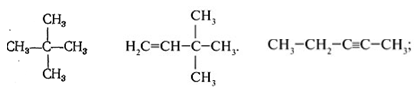
Задание 4.Составьте структурные формулы:
а) 2-метилбутен-2 напишите его изомер;
б) 3,4-диметилпентин-1.
Вариант 2.
Задание 2. Соберите модель молекулы С3Н4. Сколько спичек вы расположили между атомами углерода? Как называется эта связь? К какому классу соединений принадлежит этот углеводород? Какой тип гибридизации атомов углерода? Валентный угол? Возможно л и свободное вращение атомов при тройной связи? Запишите общую формулу углеводородов этого класса. Какие виды изомерии характерны для них?
Задание 3.Назовите вещества:
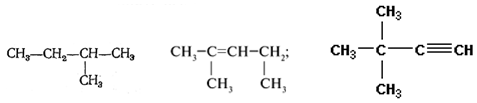
Задание 4.Составьте структурные формулы:
а) бутен-2, напишите его изомер;
б) 3,3 — диметилпентин-1.
Лабораторная работа «Изготовление моделей молекул органических веществ»
Материал опубликовалаЦель урока:
- закрепить теоретический материал.
- приобрести навыки написания структурных формул изомеров органических веществ.
- научиться собирать шаростержневые модели молекул органических веществ;
- закрепить знания на составление структурных формул изомеров и гомологов;
- познакомиться с названиями органических веществ по систематической (международной) номенклатуре ИЮПАК.
- построить шаростержневые и масштабные модели молекул первых гомологов предельных углеводородов и их галогенопроизводных.
Приборы и реактивы:
· деревянные стержни,
· материал для лепки (пластилин),
Общие указания.
Для построения моделей используйте детали готовых наборов или пластилин с палочками. Изготовьте шарики, имитирующие атомы углерода, готовят обычно из пластилина темной окраски, шарики, имитирующие атомы водорода, — из светлой окраски, атомы хлора – из зеленого или синего цвета. Для соединения шариков используют палочки (спички, зубочистки). Написав формулу органического соединения, изготовьте его пространственную структуру, используя заранее приготовленные модели атомов и применяя знания о строении молекул предельных углеводородов (угол связи, форма молекулы).
Ход занятия:
Задание 1. По формуле органического соединения напишите пространственную структуру: А) нонана Б) декан В) гексана Г) октана.
Задание 2. Напишите структурные формулы всех возможных изомеров веществ
пентана, дихлорметана Ch3Cl2, в соответствии с ними сделайте шаровидные модели изомеров на примере бутана и изобутана.
Опубликовано в группе «Учителя химии»
![]()
![]()
![]()
Опыт № 11/12. Изготовление моделей молекул органических соединений
Оборудование. Наборы разного цвета шаров и стержней.
А. Изготовление моделей углеводородов и их галогенопроизводных
Задания. 1—5. Соберите шаростержневые модели молекулы метана и его гомологов.
6—7. Соберите шаростержневые модели молекул дихлор-метана и дихлорэтана.
Выполнение опыта
1. Возьмите шарик, который условно будет изображать атом углерода, и четыре стержня (или спички), которые будут изображать связи С—Н. Объясните, почему химические связи располагаются вокруг атома углерода под углом 109°28′ относительно друг друга. Расположите четыре стержня под указанным углом между ними.
2. Мысленно или при помощи нити соедините центры ядер атомов водорода (свободные концы стержней) друг с другом. Изображение какой геометрической фигуры вы получили?
3. На свободные концы стержней прикрепите (наколите) четыре шарика. Такая модель молекулы метана называется шаростержневой моделью.
Аналогичные модели молекул, в которой детали, изображающие атомы элементов, выполняются в соответствующем масштабе, называются масштабными.
4. Соберите шаростержневые модели молекул метана, этана, пропана, бутана.
Что общего в строении молекул этих веществ, в чем различие? Чем объясняется зигзагообразное строение углеродной цепи в молекулах пропана и бутана? Какова величина угла в зигзагообразном отрезке углеродной цепи? Продемонстрируйте на моделях молекул этана и пропана возможность свободного вращения углеводородных радикалов относительно друг друга (конформация) и образования в результате этого огромного числа пространственных изомеров. Почему нельзя выделить эти изомеры?
5. Изготовьте шаростержневые модели н-бутана и н-пентана. С помощью моделей покажите возможный переход парафинов в циклопарафины и наоборот. Сохраняется ли размер валентных углов в углеродной цепи парафинов при превращении их в циклопарафины?
6. Изготовьте шаростержневые модели молекул метана и четырех молекул хлора. С помощью этих моделей продемонстрируйте поэтапное замещение атомов водорода в метане на атомы хлора с образованием хлороводорода и соответствующих галогенопроизводных метана.
7. Соберите шаростержневые модели молекул дихлорметана и дихлорэтана. Имеются ли изомеры у этих галогенопроизводных? Если да, то покажите их с помощью моделей, назовите их.
Б. Изготовление моделей молекул метиламина и диметиламина
Выполнение опыта
1. Используя приемы, описанные выше, соберите шаростержневые модели молекул аммиака и метана. Удалите по одному атому из каждой молекулы и остатки соедините свободными валентностями. Получилась модель молекулы метиламина. Сделайте вывод, что представляет собой это соединение по отношению к аммиаку и метану.
2. Соберите шаростержневую модель молекулы диметиламина. Что представляет собой это соединение по отношению к аммиаку?
Оборудование. Наборы разного цвета шаров и стержней.
А. Изготовление моделей углеводородов и их галогенопроизводных
Задания. 1—5. Соберите шаростержневые модели молекулы метана и его гомологов.
6—7. Соберите шаростержневые модели молекул дихлор-метана и дихлорэтана.
Выполнение опыта
1. Возьмите шарик, который условно будет изображать атом углерода, и четыре стержня (или спички), которые будут изображать связи С—Н. Объясните, почему химические связи располагаются вокруг атома углерода под углом 109°28′ относительно друг друга. Расположите четыре стержня под указанным углом между ними.
2. Мысленно или при помощи нити соедините центры ядер атомов водорода (свободные концы стержней) друг с другом. Изображение какой геометрической фигуры вы получили?
3. На свободные концы стержней прикрепите (наколите) четыре шарика. Такая модель молекулы метана называется шаростержневой моделью.
Аналогичные модели молекул, в которой детали, изображающие атомы элементов, выполняются в соответствующем масштабе, называются масштабными.
4. Соберите шаростержневые модели молекул метана, этана, пропана, бутана.
Что общего в строении молекул этих веществ, в чем различие? Чем объясняется зигзагообразное строение углеродной цепи в молекулах пропана и бутана? Какова величина угла в зигзагообразном отрезке углеродной цепи? Продемонстрируйте на моделях молекул этана и пропана возможность свободного вращения углеводородных радикалов относительно друг друга (конформация) и образования в результате этого огромного числа пространственных изомеров. Почему нельзя выделить эти изомеры?
5. Изготовьте шаростержневые модели н-бутана и н-пентана. С помощью моделей покажите возможный переход парафинов в циклопарафины и наоборот. Сохраняется ли размер валентных углов в углеродной цепи парафинов при превращении их в циклопарафины?
6. Изготовьте шаростержневые модели молекул метана и четырех молекул хлора. С помощью этих моделей продемонстрируйте поэтапное замещение атомов водорода в метане на атомы хлора с образованием хлороводорода и соответствующих галогенопроизводных метана.
7. Соберите шаростержневые модели молекул дихлорметана и дихлорэтана. Имеются ли изомеры у этих галогенопроизводных? Если да, то покажите их с помощью моделей, назовите их.
А. 1, 2, 3.
Потому, что этот угол (109°28′) наиболее выгоден для молекулы, получается симметричная структура: атомы и равно отдалены друг от друга и находятся на одинаковом расстоянии от атома С. Атомы водорода образуют тетраэдр, причем атом C расположен в центре.
4. Пространственное строение не изменилось.
5.
Общее: углы между связями одинаковы для разных молекул (109°28′). Зигзагообразное строение углеродной связи объясняется углом (109°28′) и способностью свободно вращаться. Пространственные изомеры нельзя выделить потому, что углеводородные радикалы вращаются свободно относительно друг друга.
6. Размер валентных углов сохраняется.
7. 8.
2.
Лабораторные опыты, лабораторная работа. Изготовление моделей молекул углеводородов Модель молекулы метан
Лабораторные опыты, лабораторная работа. Изготовление моделей молекул углеводородов Модель молекулы метана. Соберите модель молекулы метана, используя для этого заводской набор моделей атомов. Если он в школе отсутствует, соберите ее из пластилиновых шариков. Для этого из пластилина светлых тонов изготовьте четыре небольших шарика, а из пластилина темных тонов — один шарик, который примерно в два раза больше предыдущих. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями C-H составляет 109°, т. е. молекула имеет тетраэдрическое строение (см. рис. 11 на с. 25). Модели молекул бутана и изобутана. Соберите модель молекулы -бутана, используя для этого заводской набор моделей атомов или пластилин. Аналогично соберите модель молекулы изобутана. Учтите, что в бутане атомы углерода расположены по отношению друг к другу под углом 109°, т. е. углеродная цепь должна иметь зигзагообразное строение. В молекуле изобутана все связи центрального атома углерода направлены к вершинам правильного тетраэдра. Сравните строение этих углеводородов.Задача из пособия: Лабораторные опыты (Габриелян О. С. 10 класс, базовый уровень)

Лабораторные опыты, лабораторная работа. Изготовление моделей молекул углеводородов Модель молекулы метана. Соберите модель молекулы метана, используя для этого заводской набор моделей атомов. Если он в школе отсутствует, соберите ее из пластилиновых шариков. Для этого из пластилина светлых тонов изготовьте четыре небольших шарика, а из пластилина темных тонов — один шарик, который примерно в два раза больше предыдущих. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями C-H составляет 109°, т. е. молекула имеет тетраэдрическое строение (см. рис. 11 на с. 25). Модели молекул бутана и изобутана. Соберите модель молекулы -бутана, используя для этого заводской набор моделей атомов или пластилин. Аналогично соберите модель молекулы изобутана. Учтите, что в бутане атомы углерода расположены по отношению друг к другу под углом 109°, т. е. углеродная цепь должна иметь зигзагообразное строение. В молекуле изобутана все связи центрального атома углерода направлены к вершинам правильного тетраэдра. Сравните строение этих углеводородов.
Учебно-методический материал по химии по теме: Изготовление моделей углеводородов
ЛПЗ №1
«Изготовление моделей молекул углеводородов»
Цели: Научиться составлять шаростержневые модели и масштабные молекул углеводородов.
Оборудование: Набор цветного пластилина и зубочистки для моделирования, таблицы «Метан», «Этилен», «Этан», «Бутан», «Ацетилен».
Инструктивная карта
Вам предлагается составить шаростержневые модели углеводородов : этана, этилена, метана , пропана, пропилена. Первое положение теории строения органических соединений А.М.Бутлерова гласит: «Атомы в молекулах веществ соединены в определённой последовательности , согласно их валентности. Углерод в органических соединениях всегда четырёхвалентен ,а его атомы способны соединяться друг с другом, образуя различные цепи(линейные, разветвлённые и циклические)».
Задание
- Соберите шаростержневую модель и масштабную модель (полусферическую) молекулы этилена.
Для этого из пластилина светлых тонов изготовьте 4 небольших шарика, а из пластилина темных тонов 2 шарика, которые примерно в 2 раза больше предыдущих.
В качестве стержней можно использовать спички. Зарисуйте в тетради и их подпишите.
- Соберите шаростержневую модель и масштабную модель молекулы пропана, метана, этана, бутана . На шаростержневой модели черные шарики- это атомы углерода, а белые-атомы водорода. Зарисуйте в тетради и их подпишите.
- Соберите шаростержневую модель и масштабную модель молекулы ацетилена. В отличие от этилена, имеющего плоскостное строение, ацетилен имеет линейное строение. Все 4 атома молекулы ацетилена лежат на одной прямой с углами связей, равными 1800. Каждый атом углерода образует 4 химические связи -3 связи с атомом углерода и 1 –с атомом водорода. Зарисуйте в тетради и подпишите.
Вопросы:
1.Что общего в строении молекул этих веществ, в чем различие?
2. Чем объясняется зигзагообразное строение углеродной цепи в молекулах пропана и бутана?
3.Какова величина угла в зигзагообразном отрезке углеродной цепи?
Вывод:
Модель молекулы этана С2 Н6.
Модель молекулы метанаСН4.
Модель молекулы Пропана С3Н8.
Модель молекулы Бутана С4Н10.
Модели молекул метана, этана, пропана, бутана, изобутана
Ход работы:
Задание 1.Напишите структурные формулы следующих соединений:
А) нонан Б) декан В) гексан Г) октан
А____________________________________________________________________________
Б____________________________________________________________________________
В____________________________________________________________________________
Г____________________________________________________________________________
Задание 2. Соберите модель молекулы метана. Для этого из пластилина светлых тонов изготовьте четыре небольших шарика, а из пластилина темных тонов — один шарик, который приблизительно в два раза больше предыдущих. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями
С-Н составляет 109°, т.е. молекула имеет тетраэдрическое строение. Нарисуйте шаростержневую модель молекулы метана.
Задание 3. Соберите модель молекулы н-бутана, используя пластилин. Аналогично соберите модель молекулы изобутана. Учтите, что в молекуле бутана атомы углерода расположены по соотношению друг к другу под углом 109°, т.е. углеродная цепь должна иметь зигзагообразное строение. В молекуле изобутана все связи центрального атома углерода направлены к вершинам правильного тетраэдра. Сравните строение этих углеводородов. Нарисуйте шаростержневые модели молекул бутана и изобутана.
Задание 4.Напишите структурные формулы всех возможных изомеров гексана. Назовите их по международной номенклатуре.
Задание 5.Напишите структурные формулы следующих углеводородов:
А) 2-метилгексан:
Б) 2,2-диметилпентан;
В) н-пентан;
Г) 2,2-диметил-4этилгексан;
Д) 2,3,4-триметилпентан;
Е) 2-этилпентан
| А | Г |
| Б | Д |
| В | Е |
Вопросы для закрепления материала:
1.Запишите определения.
Органические соединения — _____________________________________________________
_____________________________________________________________________________
Органическая химия — __________________________________________________________
_____________________________________________________________________________
Углеводороды — _______________________________________________________________
_____________________________________________________________________________
Гомологический ряд — _________________________________________________________
_____________________________________________________________________________
Гомологи — ___________________________________________________________________
_____________________________________________________________________________
Изомеры — ____________________________________________________________________
_____________________________________________________________________________
Изомерия — ___________________________________________________________________
_____________________________________________________________________________
2. Укажите валентность элементов в органических соединениях:
А) углерода ______; Б) водорода ______; В) кислорода _______; Г) азота ______.
3. Подчеркните формулы органических соединений. ВаСО3, СН4, СО2, СН3ОН, Н2СО3, НСl, С4Н10, СО, С6Н6, Na2СО3, С2Н5СООН, С2Н2, NН3, КНСО3, СН3NН2
Выпишите формулы углеводородов_______________________________________________
_____________________________________________________________________________
4.Определите степень окисления элементов в соединениях: СН4; С2Н2; С2Н4; С5Н10; С2Н5ОН; СН3NН2
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: 90 мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:Выполнение работы более 90% –оценка «5»,
70-90% — оценка «4»,
50 -70% — оценка «3»,
Менее 50% — оценка «2».
Лабораторная работа №6
Тема работы:Кислородсодержащие органические соединения.
Цель:изучить химические свойства этилового спирта, глицерина, уксусной кислоты, глюкозы, сахарозы и крахмала.
Техника безопасности
1. Работа с нагревательными приборами.
2. Работа с химической посудой.
3. Работа с химическими реактивами.
Оборудование и реактивы: штатив с пробирками, спиртовка, медная проволока, гранулы цинка, оксид меди (II), кристаллический карбонат натрия, крахмал, растворы глицерина, гидроксида натрия, сульфата меди (II), глюкозы, сахарозы, этилового спирта, спиртового раствора йода, вода.
Задание:Выполните опыты и оформите отчет, заполнив таблицу.
Теоретическая часть
К кислородсодержащим органическим соединениям, которые состоят из атомов углерода, водорода и кислорода, относятся спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, простые и сложные эфиры, углеводы. Их химические свойства определяются наличием в молекулах различных функциональных групп.
Этиловый спирт С2Н5ОН-бесцветная жидкость со своеобразным запахом, легче воды, хорошо растворим в воде и сам является растворителем многих неорганических и органических веществ. Этанол – ядовитое наркотическое вещество. Спирт легко воспламеняется и горит синеватым почти не светящимся пламенем. Этиловый спирт реагирует со щелочными металлами с образованием алкоголятов.
2С2H5OH + 2Na = 2C2H5ONa +H2
Этанол вступает в реакцию дегидратации:
С2Н5ОН→С2Н4↑ + Н2О
Межмолекулярная дегидратация:
С2Н5ОН + НОС2Н5 = С2Н5-О-С2Н5 + Н2О
Оксид меди (II) окисляет спирт в альдегид:
С2Н5ОН + СuО = СН3-СНО + Н2О + Сu
С карбоновыми кислотами спирт образует сложные эфиры:
СН3-СООН + С2Н5ОН = СН3-СОО-С2Н5 + Н2О
Глицерин-это представитель трехатомных спиртов. Он неограниченно растворим в воде, очень гигроскопичен, не ядовит. Если оставить глицерин в открытом сосуде, его масса увеличивается до 40% за счёт поглощения влаги из воздуха. Это свойство широко используется в парфюмерной промышленности. Глицерин используют как пищевую добавку при изготовлении кондитерских изделий и напитков, при производстве пластмасс, в кожевенном производстве и текстильной промышленности, а также для изготовления взрывчатых веществ. Качественной реакцией на многоатомные спирты является их взаимодействие со свежеполученным осадком гидроксида меди (II), который растворяется с образованием ярко-синего раствора.
Карбоновые кислоты – это органические вещества в состав которых входит карбоксильная группа – СООН, связанная с углеводородным радикалом.
Класс карбоновых кислот очень разнообразен. Начинает гомологический ряд муравьиная кислота или метановая (НСООН). Муравьиная кислота – это жидкость с резким запахом, хорошо растворимая в воде, ядовита, при попадании на кожу вызывает ожоги. Жалящая жидкость, выделяемая муравьями, крапивой, некоторыми видами медуз, содержит эту кислоту. Второй представитель гомологического ряда — уксусная кислота, бесцветная жидкость с характерным запахом, смешивается с водой в любых соотношениях.
Уксусная кислота часто встречается в растениях, в выделениях животных, образуется при окислении органических веществ. Из всех карбоновых кислот она имеет самое широкое применение. Всем известно использование водного раствора уксусной кислоты – уксуса в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей). Путем различных реакций солеобразования получают соли уксусной кислоты – ацетаты. Уксусная кислота используется для получения искусственных волокон, пластмасс на основе целлюлозы, производства красителей (индиго), медикаментов (аспирин), ядохимикатов, органического стекла. Сама кислота и её эфиры являются хорошими растворителями.
При диссоциации уксусной кислоты образуются ионы водорода:
СН3COOH → СН3COO — + H+
Карбоновые кислоты реагируют с активными металлами и их оксидами, со щелочами:
2СН3СООН + 2К = 2СН3СООК + Н2
ацетат калия
СН3СООН + КОН = СН3СООК + Н2О
Взаимодействуют со спиртами с образованием сложных эфиров:
СН3CОOН + НOС2Н5 → СН3COО С2Н5 + Н2О
этиловый эфир уксусной кислоты
Углеводы представляют собой конечные продукты фотосинтеза и являются исходными веществами для биосинтеза других органических соединений. Одним из наиболее распространенных моносахаридов является глюкоза, которая имеет молекулярную формулу С6Н12О6. Глюкоза – белое кристаллическое вещество сладкого вкуса, хорошо растворимое в воде. По химическому строению глюкоза многоатомный спирт и альдегид, содержит пять гидроксильных групп –ОН и одну карбонильную группу. Как альдегид она вступает в реакции гидрирования, дает реакцию «серебряного зеркала». Как многоатомный спирт, вступает в реакцию этерификации. Специфическим свойством глюкозы является процесс брожения. Существует несколько типов брожения: спиртовое, молочнокислое и маслянокислое. В живом организме глюкоза окисляется кислородом воздуха до углекислого газа и воды, с выделением большого количества энергии.
Глюкоза – основной источник энергии в клетке. Именно она используется в лечебных целях (применяют внутрь или вводят внутривенно ослабленным больным). Кроме того глюкозу используют для получения различных соединений: этилового спирта, молочной кислоты и др. В пищевой промышленности ее применяют в качестве заменителя сахарозы. В молекуле глюкозы объединяются свойства альдегида и многоатомного спирта, поэтому глюкозу называют альдегидоспиртом. Подобно многоатомным спиртам глюкоза с гидроксидом меди (II) образуется ярко-синий раствор.
При нагревании глюкозы с Cu(OH)2 получается характерная реакция на альдегиды – «медное зеркало».
СН2ОН ─ (СНОН)4 ─ C ═ O + 2Cu(OH)2 = CH2OH ─ (CHOH)4 ─ C ═ O + Cu2O↓ + 2H2O
│ │
H OH
При нагревании глюкозы с аммиачным раствором оксида серебра получается характерная реакция на альдегиды – «серебряное зеркало».
СН2ОН ─(СНОН)4 ─C ═ O + Ag2O → CH2OH ─(CHOH)4 ─ C ═ O + 2Ag↓
│ │
H OH
Под действием биологических катализаторов – ферментов – глюкоза способна превращаться в спирт – это так называемое спиртовое брожение.
С6Н12О6 → 2С2Н5ОН + 2СО2
Крахмал представляет собой белый аморфный порошок, нерастворимый в холодной воде. В горячей воде крахмал сначала набухает, а затем дает вязкий раствор, который называется клейстером. Крахмал является смесью полисахаридов, поэтому не дает реакций, свойственных моносахаридам. Он не обладает восстановительными свойствами – не образует красного осадка оксида меди (I). При действии минеральных кислот крахмал гидролизуется до глюкозы.
(С6Н10О5)n + nH2O → nC6H12O6
Характерной реакцией на крахмал является реакция его с раствором иода — раствор окрашивается в интенсивный синий цвет.
Ход работы
| Опыт | Результаты | |
| Опыт №1 Окисление этилового спирта оксидом меди (II). | В пробирку поместите 4 капли этилового спирта и погрузите в нее прокаленную медную спираль, покрытую черным налетом оксида меди (II). | Что наблюдаете? ___________________________________ ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ |
| Опыт №2 Получение глицерата меди | В пробирку налейте 1 мл 10%-го раствора сульфата меди (II) и добавьте немного 10%-го раствора гидроксида натрия. К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. | Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ ___________________________________ |
| Опыт №3 Свойства уксусной кислоты. | В три пробирки налейте по 2 мл уксусной кислоты. В первую пробирку добавьте гранулу цинка, во вторую – несколько крупинок оксид меди (II), в третью – кристаллический карбонат натрия. | Что наблюдаете? 1 пробирка__________________________ 2 пробирка__________________________ 3 пробирка__________________________ Напишите уравнения реакций 1 __________________________________ ___________________________________ 2 __________________________________ ___________________________________ 3 _________________________________ ___________________________________ |
| Опыт №4 Действие гидроксида меди (II) на глюкозу. | а) В пробирку прилейте 0,5 мл раствора глюкозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). б) К полученному раствору добавьте 1 мл воды и нагрейте на пламени спиртовки только верхнюю часть раствора. | Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ Что наблюдаете? ___________________________________ Напишите уравнение реакции ___________________________________ ____________________________________ |
| Опыт №5 Действие гидроксида меди (II) на сахарозу. | В пробирку прилейте 0,5 мл раствора сахарозы и 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора сульфата меди (II). Полученный раствор осторожно нагрейте. | Что наблюдаете? ___________________________________ ___________________________________ Напишите уравнение реакции ___________________________________ ___________________________________ |
| Опыт №6 Действие йода на крахмал. | В стакан с 20 мл воды, нагретой до кипения, добавьте 2 г крахмала, хорошо размешайте образовавшуюся суспензию до образования прозрачного коллоидного раствора – крахмального клейстера. Налейте в пробирку 2-3 мл охлажденного клейстера и добавьте несколько капель спиртового раствора йода. Нагрейте смесь в пробирке. | Что наблюдаете? ___________________________________ __________________________________ __________________________________ __________________________________ ___________________________________ ___________________________________ |
Общий вывод:_________________________________________________________________
__________________________________________________________________
_______________________________________________________________
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
Вопросы для закрепления материала:
1. Почему глюкоза проявляет свойства альдегидов и спиртов?
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
2. Почему сахароза не дает реакцию «серебряного зеркала»?
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
3. Как можно обнаружить крахмал в продуктах питания?
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
4. В трех пробирках находятся растворы: уксусной кислоты, глюкозы и глицерина. Определите характерными реакциями, в какой из пробирок находится какое вещество, и напишите уравнения реакций.
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
________________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
5. Осуществите превращение: CO2 → C6H12O6 → C2H5OH → CO2
______________________________________________________________
________________________________________________________________________________
______________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: 90 мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки:Выполнение работы более 90% –оценка «5»,
70-90% — оценка «4»,
50 -70% — оценка «3»,
Менее 50% — оценка «2»
Литература
Основная:
1. Ерохин Ю.М. Химия для профессий и специальностей технического и естественно-научного профиля: учебник для студ. учреждений сред. проф. образования. — М., 2016.
2. Габриелян, О.С. Химия для профессий и специальностей технического профиля. — М., 2014.
3. Егоров А.С. Химия для колледжей. – Ростов н/Д , 2013.
Дополнительная:
1. Габриелян, О.С. Химия: тесты, задачи и упражнения: учеб. пособие для студ. учреждений сред. проф. образования. — М., 2014.
2. Ерохин Ю.М. Сборник задач и упражнений по химии (с дидактическим материалом). — М., 2005.
3. Маршанова, Г.Л. Техника безопасности в школьной химической лаборатории: Сборник инструкций и рекомендаций. – М., 2002.
Интернет – ресурсы:
www. pvg. mk. ru (олимпиада «Покори Воробьевы горы»).
www. hemi. wallst. ru (Образовательный сайт для школьников «Химия»).
www. alhimikov. net (Образовательный сайт для школьников).
www. chem. msu. su (Электронная библиотека по химии).
www. enauki. ru (интернет-издание для учителей «Естественные науки»).
www. 1september. ru (методическая газета «Первое сентября»).
www. hvsh. ru (журнал «Химия в школе»).
www. hij. ru (журнал «Химия и жизнь»).
www. chemistry-chemists. com (электронный журнал «Химики и химия»).

Leave a Reply