Кристаллы поваренной соли – Выращивание кристаллов. Как вырастить кристалл. Кристаллы поваренной соли, кристаллы медного купороса
Выращивание кристаллов. Как вырастить кристалл. Кристаллы поваренной соли, кристаллы медного купороса
Выращивание кристаллов.Что нужно знать!
Выращивание кристаллов — процесс очень интересный, но бывает достаточно длительным. Полезно знать, какие процессы управляют его ростом; почему разные вещества образуют кристаллы различной формы, а некоторые их вовсе не образуют; что надо сделать, чтобы они получились большими и красивыми.
Если кристаллизация идёт очень медленно, получается один большой кристалл (или монокристалл, например при выращивании искусственных камней), если быстро — то множество мелких (или поликристалл, например металлы).
Выращивание кристаллов в домашних условиях производят разными способами. Например, охлаждая насыщенный раствор. С понижением температуры растворимость веществ уменьшается (в основном, это касается безводной соли), и они, как говорят, выпадают в осадок. Сначала в растворе и на стенках сосуда появляются крошечные кристаллы-зародыши. Когда охлаждение медленное, а в растворе нет твёрдых примесей (скажем, пыли), зародышей образуется немного, и постепенно они превращаются в красивые кристаллики правильной формы. При быстром охлаждении возникает много мелких кристалликов, почти никакой из них не имеет правильную форму, ведь их растёт множество и они мешают друг другу.
 Кристалл сахара
Кристалл сахараВыращивание кристаллов можно осуществить и другим способом — постепенным удалением воды из насыщенного раствора. И в этом случае чем медленнее удаляется вода, тем лучше получается результат. Оставьте открытым сосуд с раствором при комнатной температуре на длительный срок, накрыв его листом бумаги, — вода при этом будет испаряться медленно, и пыль в раствор попадать не будет. Растущий кристаллик можно либо подвесить в насыщенном растворе на тонкой прочной нитке, либо положить на дно сосуда. В последнем случае кристаллик периодически надо поворачивать на другой бок. По мере испарения воды в сосуд следует подливать свежий раствор. Даже если наш исходный кристаллик имел неправильную форму, он рано или поздно сам выправит все свои дефекты и примет форму, свойственную данному веществу, например превратится в октаэдр, если используете соль хромокалиевых квасцов, ромб — если используете медный купорос.
 Кристаллы
Кристаллы калий-алюминиевых квасцов
Выращивание кристаллов — процесс занимательный, но требующий бережного и осторожного отношения к своей работе. Теоретически размер кристалла, который можно вырастить в домашних условиях таким способом, неограничен. Известны случаи, когда энтузиасты получали кристаллы такой величины, что поднять их могли только с помощью товарищей.
Но, есть некоторые особенности их хранения (конечно каждая соль и вещество имеют свои особенности). Например, если кристаллик квасцов оставить открытым в сухом воздухе, он, постепенно теряя содержащуюся в нём воду, превратится в невзрачный серый порошок. Чтобы предохранить его от разрушения, можно покрыть бесцветным лаком. Медный купорос и поваренная соль — более стойки и Вы смело можете с ними работать.
Как вырастить кристалл
 Кристалл йодида калия
Кристалл йодида калия(KI)
Вырастить кристалл можно из разных веществ: например из сахара, даже каменные — искусственное выращивание камней, с соблюдением строгих правил по температуре, давлению, влажности и других факторов (искусственные рубины, аметисты, кварц, цитрины, морионы).
Вот теперь можем приступить!
Выращивание кристаллов поваренной соли

(NaCl)
Кристаллы поваренной соли — процесс выращивания не требует наличия каких-то особых химических препаратов. У нас всех есть пищевая соль (или поваренная соль), которую мы принимаем в пищу. Её также можно назвать и каменной — всё одно и то же. Кристаллы поваренной соли NaCl представляют собой бесцветные прозрачные кубики.
Начнём. Разведите раствор поваренной соли следующим образом: налейте воды в ёмкость (например стакан) и поставьте его в кастрюлю с тёплой водой (не более 50°С — 60°С). Конечно, в идеальном варианте, если вода не будет содержать растворённых солей (т.е. дистиллированная), но в нашем случаем можно воспользоваться и водопроводной. Насыпьте пищевую соль в стакан и оставьте минут на 5, предварительно помешав. За это время стакан с водой нагреется, а соль растворится. Желательно, чтобы температура воды пока не снижалась. Затем добавьте ещё соль и снова перемешайте. Повторяйте этот этап до тех пор, пока соль уже не будет растворяться и будет оседать на дно стакана.
Мы получили насыщенный раствор соли. Перелейте его в чистую ёмкость такого же объёма, избавившись при этом от излишек соли на дне.
Выберите любой понравившийся более крупный кристаллик поваренной соли и положите его на дно стакана с насыщенным раствором. Можно кристаллик привязать за нитку и подвесить, чтобы он не касался стенок стакана.
Теперь нужно подождать.
Уже через пару дней можно заметить значительный для кристаллика рост. С каждым днём он будет увеличиваться. А если проделать всё то же ещё раз (приготовить насыщенный раствор соли и опустить в него этот кристаллик), то он будет расти гораздо быстрее (извлеките кристаллик и используйте уже приготовленный раствор, добавляя в него воды и необходимую порцию пищевой соли). Помните, что раствор должен быть насыщенным, то есть при приготовлении раствора на дне стакана всегда должна оставаться соль (на всякий случай).
Для сведений: в 100г воды при температуре 20°С может раствориться приблизительно 35 г поваренной соли. С повышением температуры растворимость соли растёт.
Выращивание кристаллов медного купороса
Кристаллы медного купороса — выращиваются подобным образом, также, как с поваренной солью: сначала готовится насыщенный раствор соли, затем в этот раствор опускается понравившийся маленький кристаллик соли медного купороса.
Внимание! медный купорос- — химически активная соль! Поэтому для удачности опыта в этом случае воду нужно взять дистиллированную, т.е. не содержащую других растворённых в ней солей. Из под крана воду тоже лучше не брать, так как она во-первых содержит растворённые соли, во-вторых может быть сильно хлорированной. Примеси (особенно карбонаты в жёсткой вроде) вступают в химические реакции с медным купоросом, из-за чего раствор сильно портится
Если всё в порядке, — продолжим. Если Вы решили не переливать раствор из ёмкости, в которой первоначально рос маленький кристаллик, тогда подвесьте кристаллик, что бы он не касался других кристалликов, оставшихся на дне!
Выращивание кристаллов производят не только из растворов, но и из расплавов соли. Ярким примером могут служить жёлтые непрозрачные кристаллы серы, имеющие форму ромба или вытянутых призм. Но с серой, особо, работать не советую. Газ, образующийся при её испарении,
вреден для здоровья.
Выращивание кристаллов меди
: Кристаллы меди (Cu)
Кристаллы меди (Cu)Теперь вырастим красные кристаллы меди. Нам необходимы медный купорос, поваренная соль, стальная пластинка по форме сечения ёмкости (немного меньшего периметра. Можно использовать стальную стружки или кнопки), где будут расти кристаллы меди и кружок из промокательной бумаги в форме сечения. Итак, положите немного медного купороса на дно пузырька (желательно равномерно по площади). Сверху насыпьте поваренной соли и закройте всё это вырезанным кружком бумаги. На неё положите железную пластинку (или засыпьте стальной стружкой). Всё это вместе надо залить насыщенным раствором поваренной соли (такой раствор мы готовили из поваренной соли). Оставьте ёмкость приблизительно на неделю. За это время вырастут иглоугольные красные кристаллы меди. Когда идёт процесс роста старайтесь не переносить ёмкость, а также очень нежелательно изымать кристаллики из раствора.
Можно вырастить кристалл разноцветным и многослойным. Их получают путём приготовления растворов квасцов (двойные соли серной кислоты) и переносят поочерёдно выращиваемый кристаллик из одного раствора в другой.
Если смешать горячие концентрированные растворы сульфатов алюминия Al2(SO4)3 и калия K2(SO4), а полученный раствор охладить, то из него начнут кристаллизоваться квасцы — двойной сульфат калия и алюминия 2KAl(SO4)2•12Н2О. Квасцы растворяются в воде так: 5,9 г на 100 г воды при 20 °С, но уже 109 г — при 90 °С в пересчёте на безводную соль. При хранении на воздухе квасцы выветриваются. При температуре 92,5 °С они плавятся в своей кристаллизационной воде, а при нагревании до 120 °С обезвоживаются, переходя в жжёные квасцы, которые разлагаются лишь при температуре выше 700 °С. Молекулы воды, входящие в состав квасцов, связаны химической связью с ионами калия и алюминия, поэтому соли квасцов имеют формулу, которую правильнее записывать в виде комплексной соли [K(H2O)6][Al(H2O)6](SO4)2.
Кое-что о жидких кристаллах
Жидкие кристаллы — это вещества, которые ведут себя одновременно как жидкости и как твёрдые тела. Молекулы в жидких кристаллах, с одной стороны, довольно подвижны, с другой — расположены регулярно, образуя подобие кристаллической структуры (одномерной или двумерной). Часто уже при небольшом нагревании правильное расположение молекул нарушается, и жидкий кристалл становится обычной жидкостью. Напротив, при достаточно низких температурах они замерзают, превращаясь в твёрдые тела. Регулярное расположение молекул в жидких кристаллах обусловливает их особые оптические свойства. Их свойствами можно управлять, подвергая действию магнитного или электрического поля. Это используется в жидкокристаллических индикаторах часов, калькуляторов, компьютеров и последних моделей телевизоров.
Итак, процесс выращивание кристаллов в домашних условиях разделим на основные этапы:
Этап 1: Растворить соль, из которой будет расти кристалл, в подогретой воде (подогтерть нужно для того, чтобы соль растворилось немного больше, чем может раствориться при комнатной температуре). Растворять соль до тех пор, пока будете уверены, что соль уже больше не растворяется (раствор насыщен!). Рекомендую использовать дистиллированную воду (т.е. не содержащую примесей других солей)
Этап 2: Насыщенный раствор перелить в другую ёмкость, где можно производить выращивание кристаллов (с учётом того, что он будет увеличиваться). На этом этапе следите, чтобы раствор не особо остывал.
Этап 3: Привяжите на нитку кристаллик соли, нитку привяжите например к спичке и положите спичку на края стакана (ёмкости), где налит насыщенный раствор (этап 3). Кристаллик опустите в насыщенные раствор.
Этап 4: Перенесите ёмкость с насыщенным раствором и кристалликом в место, где нет сквозняков, вибрации и сильного света (выращивание кристаллов требует соблюдение этих условий).
Этап 5: Накройте чем-нибудь сверху ёмкость с кристалликом (например бумагой) от попадания пыли и мусора. Оставьте раствор на пару дней.
Важно помнить!
1. кристаллик нельзя при росте без особой причины вынимать из раствора
2. не допускать попадание мусора в насыщенные раствор, наиболее предпочтительно использовать дистиллированную воду
3. следить за уровнем насыщенного раствора, периодически (раз в неделю или две) обновлять при испарении раствор
Графики растворимости соли в воде
Выращивание кристаллов. ЧТО НУЖНО ЗНАТЬ!
Хлорид натрия — Википедия
| Хлорид натрия | |
|---|---|
 ( ({{{картинка3D}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое наименование | Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Хим. формула | NaCl |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Температура | |
| • плавления | 800,8 °C |
| • кипения | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия | |
| • образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Растворимость | |
| • в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| • в метаноле | 1,49 г/100 мл |
| • в аммиаке | 21,5 г/100 мл |
| Показатель преломления | 1,544202 (589 нм) |
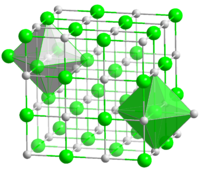
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | |
| InChI | |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | 5044 |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
 Кристалл хлорида натрия
Кристалл хлорида натрияХлори́д на́трия или хлористый натрий (NaCl) — натриевая соль соляной кислоты. Известен в быту под названием поваренной соли, основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде[⇨]. Встречается в природе в виде минерала галита (каменной соли). Чистый хлорид натрия представляет собой бесцветные кристаллы, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 1015 тонн NaCl, то есть из каждой тонны морской воды можно получить в среднем 1,3 кг хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, содержат NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах тёплых морей или на соляных озёрах, где на мелководье солёная вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит[править | править код]
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решётку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2,2 г/см³, а твёрдость по шкале Мооса — 2. Бесцветный прозрачный минерал со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и тому подобных.[4]
Каменная соль[править | править код]
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (жёлтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, иодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и так далее[4].
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль[править | править код]
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
 Очищенная кристаллическая морская соль
Очищенная кристаллическая морская сольПри испарении морской воды при температуре от +20 до +35 °C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль из Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи[править | править код]
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, Кулундинское озеро, Эбейты и другие озёра в Западной Сибири.
Производство[править | править код]
В древности технология добычи соли заключалась в том, что соляную рапу (раствор) вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённый солевой раствор выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой жёлобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 году новгородский князь Святослав определил налог на соляные варницы[6]:
 | …на мори от чрена и от салгы по пузу…[7] |  |
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли.
Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
-

Добыча соли в южной части Мертвого моря, Израиль
-

Кристаллы каменной соли
-

Плантация морской соли в Дакаре
-

Соляные кучи на солончаке Уюни, Боливия
В пищевой промышленности и кулинарии[править | править код]
Соль повареннаяВ пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывания соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах, %:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10−4 %, фтора (25,0 ± 5,0) × 10−3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15%-ное содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине[править | править код]
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % раствор) используют как вспомогательный осмотический диуретик при отёке головного мозга, для поднятия давления при кровотечениях, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль[править | править код]
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололёда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта ввиду коррозийных процессов.
Регенерация Nа-катионитовых фильтров[править | править код]
Nа-катионитовые фильтры широко применяются в установках умягчения воды всех мощностей при водоподготовке. Катионитным материалом на современных водоподготовительных установках служат в основном глауконит, полимерные ионообменные смолы и сульфированные угли. Наиболее распространены сульфокатионитные ионообменные смолы.
Регенерацию Nа-катионитовых фильтров осуществляют 6—10%-м раствором поваренной соли, в результате катионит переводится в Na-форму, регенерируется. Реакции идут по уравнениям:
- CaR2+2NaCl→2NaR+CaCl2{\displaystyle {\mathsf {CaR_{2}+2NaCl\rightarrow 2NaR+CaCl_{2}}}}
- MgR2+2NaCl→2NaR+MgCl2{\displaystyle {\mathsf {MgR_{2}+2NaCl\rightarrow 2NaR+MgCl_{2}}}}
Химическая промышленность[править | править код]
Соль, наряду с каменным углём, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl+3h3O→NaClO3+3h3{\displaystyle {\mathsf {NaCl+3H_{2}O\rightarrow NaClO_{3}+3H_{2}}}}
Получение хлора и гидроксида натрия[править | править код]
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H+, образованных в результате электролитической диссоциации воды:
- h3O⇄H++OH−{\displaystyle {\mathsf {H_{2}O\rightleftarrows H^{+}+OH^{-}}}}
- 2H++2e−→h3{\displaystyle {\mathsf {2H^{+}+2e^{-}\rightarrow H_{2}}}}
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl→Na++Cl−{\displaystyle {\mathsf {NaCl\rightarrow Na^{+}+Cl^{-}}}}
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2NaCl+2h3O→2NaOH+Cl2↑+ h3↑{\displaystyle {\mathsf {2NaCl+2H_{2}O\rightarrow 2NaOH+Cl_{2}\!\uparrow +\ H_{2}\!\uparrow }}}
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор при повышенном давлении сжижается в жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворённый в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2NaOH+Cl2→NaCl+NaOCl+h3O{\displaystyle {\mathsf {2NaOH+Cl_{2}\rightarrow NaCl+NaOCl+H_{2}O}}}
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подаётся в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH крайне мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na++e−→Na(Hg){\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na_{(Hg)}}}}
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2Na(Hg)+2h3O→2NaOH+h3↑{\displaystyle {\mathsf {2Na_{(Hg)}+2H_{2}O\rightarrow 2NaOH+H_{2}\!\uparrow }}}
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия[править | править код]
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- Na++e−→Na{\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na}}}
- на аноде выделяется хлор (как побочный продукт):
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2Na++2Cl−→2Na+Cl2{\displaystyle {\mathsf {2Na^{+}+2Cl^{-}\rightarrow 2Na+Cl_{2}}}}
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (+800 °C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления +580 °C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (+371 K = 98 °C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия[править | править код]
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между твёрдым хлоридом натрия и концентрированной серной кислотой:
- NaCl+h3SO4 →t<110oC NaHSO4+HCl↑{\displaystyle {\mathsf {NaCl+H_{2}SO_{4}\ {\xrightarrow {t<110^{o}C}}\ NaHSO_{4}+HCl\uparrow }}}
- NaCl+NaHSO4 →450−800oC Na2SO4+HCl↑{\displaystyle {\mathsf {NaCl+NaHSO_{4}\ {\xrightarrow {450-800^{o}C}}\ Na_{2}SO_{4}+HCl\uparrow }}}
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идёт почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства[править | править код]
Температура плавления +800,8 °С, кипения +1465 °С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в граммах на 100 г воды) равен 35,9 при +21 °C и 38,1 при +80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca2+, Mg2+ и SO2−
4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H2O можно выделить при температуре ниже +0,15 °C[21].
Смесь измельчённого льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 °C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 °C. Лёд, имеющий температуру около 0 °C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства[править | править код]
При действии концентрированной серной кислоты на твёрдый хлорид натрия выделяется хлороводород:
- 2NaCl+h3SO4→t>110oCNa2SO4+2HCl↑{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}{\xrightarrow {t>110^{o}C}}Na_{2}SO_{4}+2HCl\uparrow }}}
С раствором нитрата серебра образует белый осадок хлорида серебра (качественная реакция на хлорид-ион):
- NaCl+AgNO3→NaNO3+AgCl↓{\displaystyle {\mathsf {NaCl+AgNO_{3}\rightarrow NaNO_{3}+AgCl\downarrow }}}
При смешивании с сульфатом меди в растворе получается тетрахлоркупрат натрия, при этом синий раствор зеленеет из-за преобладания гидратированного иона [CuCl4(h3O)2]2−{\displaystyle {\ce {[CuCl4(h3O)2]^2-}}}[22] :
- CuSO4+4NaCl⇄Na2[CuCl4]+Na2SO4{\displaystyle {\mathsf {CuSO_{4}+4NaCl\rightleftarrows Na_{2}[CuCl_{4}]+Na_{2}SO_{4}}}}
Исследовательская работа на тему «Выращивание кристаллов поваренной соли и сахара в домашних условиях
Муниципальное бюджетное общеобразовательное учреждение
Останкинская средняя школа
городского округа город Бор Нижегородской области
Выращивание кристаллов поваренной соли и сахара в домашних условиях

Выполнил обучающийся 2 класса
Павловский Иван
Руководитель: Маслова Нина Ивановна,
учитель начальных классов
с.Останкино 2017 .
Содержание:
Теоретическая частьЧто такое кристаллы?
4
Практическая часть
5-7
Заключение
8
Список используемой литературы
9
Введение
Случалось ли вам слышать слово «кристалл»? Разумеется. Но спросите себя, какие кристаллы вам знакомы? Первыми на ум приходят снежинки и самоцветы: изумруд, лиловый аметист, вишнёво-красный гранат, а кто-то горный хрусталь. В кристаллах есть что-то удивительное и завораживающее. Природные кристаллы всегда возбуждали любопытство у людей.
Однажды на день рождения мне подарили набор для юного химика «Выращивание кристаллов». Работа была интересная. Кристаллы получились удивительной формы. На уроке окружающего мира мы рассматривали различные формы снежинок. Оказалось, что это тоже кристаллы.
Меня заинтересовал вопрос: возможно ли вырастить кристаллы в домашних условиях без применения специальных приспособлений и из каких веществ?
Гипотеза исследования: я предположил, что кристаллы могут появляться при создании определенных условий; значит, если растворить различные вещества, то можно получить кристаллы в домашних условиях
Цель работы: провести исследование по выращиванию кристаллов поваренной соли и сахара в домашних условиях.
Для достижения поставленной цели необходимо решить следующие задачи:
изучить литературу, посвященной данной теме;
познакомиться с методами выращивания кристаллов;
Выполнить опытно-экспериментальную работу по изученным методикам.
Актуальность работы состоит в том, что выращивание кристаллов — увлекательное занятие и самое простое, доступное и недорогое.
Предмет исследования: кристаллы.
Объект исследования: процесс кристаллизации.
Методы исследования:
Накопление теоретического материала.
Проведение опытно-экспериментальной деятельности с целью получения кристаллов из поваренной соли и сахара.
Анализ полученных результатов исследования.
Теоретическая часть.
Что такое кристалл?
Что же такое кристаллы? Кристаллы, в переводе с греческого языка, (krystallos) лёд. По данным энциклопедии, кристалл — это твердое тело. Кристаллы бывают естественного происхождения и искусственного, выращенные в специально-созданных условиях. И каждый человек, при желании может легко вырастить кристаллы у себя дома.
Оказалось, многие из самых обычных веществ вокруг нас, представляют из себя кристаллы. Мы встречаемся с ними повсюду и даже не подозреваем об этом.
• Кристаллы хрустят у нас под ногами почти полгода (а в полярных областях земли круглый год) покрывая огромные пространства земли — это снег.
• А любимое многими развлечение кататься на коньках, лед — это тоже кристалл!
• На кухне — едим кристаллы, например, соль или сахар.
• Лечимся кристаллами – лучи от кварцевой лампы используются в медицине для дезинфекции.
Люди научились выращивать искусственные кристаллы рубины. Используют их для изготовления ювелирных украшений и в часовых механизмах.
Выращивают и самые твердые на свете кристаллы алмазы. Сегодня алмаз не камень-украшение, а в первую очередь камень-работник. Благодаря своей исключительной твердости алмаз играет огромную роль в технике. Алмазными пилами распиливают камни.
Практическая часть.
У меня возник вопрос: можно ли кристаллы вырастить дома и из каких веществ? Чтобы найти ответ на этот вопрос: в интернете нашел несколько вариантов выращивания кристаллов в домашних условиях из соли, сахара, медного купороса, а таких как рубины и алмазы, к сожалению, нет.
Определив методы исследования, провел работу по выращиванию кристаллов в домашних условиях.
Опыт 1. Выращивание кристаллов из поваренной соли.
Берём соль, добавляем в банку с водой и перемешиваем. Добавляем ещё соль и снова перемешиваем. Повторяем этот этап до тех пор, пока соль не будет растворяться, и станет оседать на дно банки. Мы получили насыщенный раствор соли.

Переливаем его в чистую ёмкость.



Привязываем нитку и подвешиваем, чтобы она не касалась стенок стакана.
Уже через пару дней можно заметить кристаллики на нитке. С каждым днём они будет увеличиваться в размере и количестве.
Результат: мы получили кристаллы поваренной соли.
Вывод:
1. Поваренная соль состоит из кристаллов.
2. При соприкосновении кристаллов соли с водой, они растворяются.
3. В домашних условиях можно вырастить кристаллы при необходимых условиях: наличие насыщенного солевого раствора и ниточки.


Опыт 1. Выращивание кристаллов из сахара.
Берем сахар и растворяем в небольшом количестве воды, подогревая на плите. Получается сироп. Сиропом поливаем шпажки, и обмакиваем в сахар. Получаем заготовки, которые должны сохнуть ночь.




Готовим снова сироп. Растворяем сахар в небольшом количестве воды на огне. Остужаем. Разливаем сироп по баночкам. Чтобы кристаллы получились красивее, подкрашиваем сироп пищевым красителем. Опускаем в сироп заготовки так, чтобы не касались стенок баночек. Через пару дней начнут расти кристаллы. Ждем еще несколько дней и любуемся получившимися кристаллами.



Результат: мы получили цветные кристаллы сахара.
Вывод:
1. Сахар состоит из кристаллов.
2. При соприкосновении кристаллов сахара с водой, они растворяются.
3. По мере того как вода испаряется, сахар снова образует кристаллы.
В результате проведенных исследований гипотеза полностью подтверждается: нам удалось вырастить кристаллы поваренной соли и сахара в домашних условиях.
Вывод:
при благоприятных условиях поваренная соль и сахар принимают форму кристаллов;
кристаллы различных веществ имеют разную форму;
кристаллы различных веществ имеют различные свойства (одни кристаллы растут быстрее, другие – медленнее).
Заключение
Я узнал, что кристаллы очень полезны для человека. В некоторых случаях без них не обойтись. Например, если нужно разрезать камень, не обойтись без алмаза, а если нужно сделать часы, то не обойтись без рубина.
Выводы:
В результате исследования мои гипотезы подтвердились.
Кристаллы можно получить из некоторых веществ в домашних условиях, только нужно знать способы их выращивания.
Я вырастил кристаллы из поваренной соли и сахара.
Я планирую вырастить кристаллы и из других веществ.
Список используемой литературы:
Сайт Википедия http://ru.wikipedia.org/ Статья «Кристаллы»
Сайт «Рисуя кристаллы» http://mindraw.web.ru/mineral1.htm Статья «Кварц и его разновидности»
Физико-химический эксперимент
http://mirkristallov.com/- Мир кристаллов
Информационно-образовательный портал «Должен все знать» — http://dz-online.ru/article/2288/
http://kubirubi.livejournal.com/155682.html- Игры с водой
Исследовательская работа » Как вырастить кристаллы соли в домашних условиях?»
МУНИЦИПАЛЬНОЕ КАЗЁННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ НИЖНЕТЕРЯНСКАЯ СРЕДНЯЯ
ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 28
КАК ВЫРАСТИТЬ КРИСТАЛЛЫ СОЛИ В ДОМАШНИХ УСЛОВИЯХ?
Конкурс «Страна чудес — страна исследований»
(Исследовательская работа)
Выполнили:
ученики 4 класса
МКОУ Нижнетерянской СОШ № 28
Ирина Денисовна Кузурман
Денис Владимирович Голубев
Руководитель:
учитель начальных классов
МКОУ Нижнетерянской СОШ № 28
Надежда Викторовна Федоренко
Нижнетерянск 2011
1.1. Исторические сведения о поваренной соли 5
1.2. Значение поваренной соли в жизни человека 7
1.3. Лечебные свойства соли 9
1.4. Использование соли в хозяйства 10
1.5. Кристаллы 11
1.6. Опыты по выращиванию кристаллов 12
1.7. Выводы по результатам проведённых опытов 16
Заключение
Литература
Приложение
ВВЕДЕНИЕ
Новый год — один из любимейших народом праздников. В преддверии праздника и взрослые, и дети с нетерпением ждут, когда в доме появится сверкающая красавица ёлка, а на ней сверкающие игрушки.
Дома ёлка может простоять не долго. Через несколько дней с неё начинают опадать иголки. А можно ли сделать так, чтобы если не вся ёлка, а хотя бы букет из её веточек мог бы радовать нас и напоминать о зиме, о Новом годе? Сделать такой букет не сложно, но хотелось, чтобы он был в снегу. Мы понимали, что настоящий снег растает. Тогда мы попробовали найти информацию в сети Интернет. Оказалось, что искусственный снег может быть из пенопласта, а также из соли. Мы решили взять соль. Соль, которая есть на каждом столе, в каждом доме, известная и знакомая, непознанная и таинственная!
Гипотеза: Мы предположили, что кристаллы соли могут появляться при создании определенных условий; значит, если изменять условия кристаллизации, то можно получать кристаллы разной формы и цвета.
Цель: Вырастить кристаллы поваренной соли и других солей в домашних
условиях.
Задачи:
1. Изучить исторические сведения о поваренной соли;
2. Узнать о значении поваренной соли в жизни человека;
3. Подобрать дома и в школьной лаборатории доступное оборудование и сырье для выращивания кристаллов;
4. Вырастить кристаллы солей;
5. Изучить условия образования кристаллов, их формы, цвета;
6. Проанализировать полученные результаты
Методы и методики:
Изучение и обработка литературы по теме.
Проведение опытов.
Наблюдения.
Обработка результатов.
Обобщение полученных результатов.
Исторические сведения о поваренной соли.
Поваренная соль есть в каждом доме. Вряд ли мы узнаем, когда впервые наши далекие предки вкусили соль: нас отделяют от них десять-пятнадцать тысяч лет. Тогда еще не было посуды для приготовления пищи, все растительные продукты люди вымачивали в воде и подпекали на тлеющих углях, а мясо, насаженное на палки, обжаривали в пламени костра. Возможно, однажды, за неимением пресной воды, мясо, либо корни и листья растений были замочены в соленой морской или озерной воде, и еда оказалась вкуснее обычной. Может быть, добытое впрок мясо, чтобы защитить его от плотоядных животных, люди прятали в морскую воду, а потом обнаружили, что оно приобрело иной вкус. Наблюдательные охотники первобытных племен могли заметить, что животные любят лизать солонцы – белые кристаллы каменной соли, выступающие кое-где из-под земли, и попробовали добавлять соль в пищу. Могли быть и другие случаи первого знакомства людей с этим удивительным веществом.
Если обратиться к истории, то можно убедиться насколько ценным было это вещество для человека.
Латинское слово “salarium” и английское слово “salary”, означающие «жалование», «зарплата», — имеют «солевое» происхождение. По своей ценности она приравнивалась к золоту. Солью запасались на случай бедствий и ею расплачивались вместо денег. В Римской империи легионерам жалование платили солью. Отсюда и произошло слово «солдат». Соль хранили в особых ларцах, меняли не только на товары, но даже на землю. В Китае, в 18 веке, делали монеты из каменной соли. Ломоносов писал, что за четыре небольших куска соли в Абиссинии можно было купить раба. В России еще с 16 века известные русские предприниматели Строгановы самые большие доходы получали от добычи соли. Строгановы были самыми крупными солеварами. Жили они в Пермском крае. Прикамье было очень богато на выходы соленой грунтовой воды. Именно соль и прославила в то время Пермский край на всю Россию. Отсюда и с предгорий Урала соль отправлялась в Москву, Казань, Нижний Новгород, Калугу, даже за границу.
Многие века соль была источником обогащения торговцев и предпринимателей. К соли всегда относились уважительно, экономно. Отсюда народная примета – соль рассыпал – к ссоре.
Соль упоминается и в Библии. В Библии соль – это символ дружбы, солидарности, жизни, мудрости. Это некоторые значения соли в Библии. Но, с другой стороны, она имеет и негативное значение: сама по себе является невкусной; солёная вода не утоляет жажды; соль жжёт, если приложить её к ране. Поэтому, например, древние греки и римляне, чтобы совсем уничтожить какой-нибудь вражеский город, после его разрушения бросали на руины соль.
1.2. Значение поваренной соли в жизни человека.
Соль издавна на Руси имела большое значение. Недаром в России дорогих гостей принято встречать «хлебом и солью», Встреча гостей хлебом-солью имела ещё одно важное значение – соль была своеобразным оберегом, наши предки верили, что соль защищает от враждебных сил. Значение слова хлеб-соль: хлебосоль — это обед, стол, пища, предлагаемая посетителю, и угощенье. Хлеб-соль водить, знаться, дружиться с кем либо.
Есть на Руси такой обычай,
С детских лет он нам привычен
Хлебом да солью всех гостей встречать
Низко в пояс поклониться,
Чем богаты поделиться
За столом по-русски,
Щедро угощать…
О соли сложено много загадок и пословиц.[1] (Приложение 1)
С давних времен соль присутствует в легендах, сказках разных народов. В русской народной сказке «Соль» говорится о том, как Иван продал заморскому королю корабль простой соли за полный корабль золота и серебра.[4]
Русская народная сказка «Лиса и журавль» заканчивается такими словами: «Взяла лису досада. Думала, что наестся на целую неделю, а домой пошла — не солоно хлебала». Несолоно хлебавши — значит, не получила удовольствия, ничего не добилась, осталась голодная. Выражение появилось в те времена, когда соль была дорогим продуктом. Случалось, что в богатом доме важные гости «хлебали солоно», а незнатным гостям доставалась несолёная пища.
В наше время соль уже не ценится настолько дорого. Ее можно купить в любом продуктовом магазине. Но, тем не менее, она не перестает играть очень важную роль в жизни человека. Люди используют ее не только в пищу, но и в быту, медицине, промышленности.
Соль — это единственный минерал, используемый человеком в пищу в «естественном» виде, практически без переработки. В природе соль встречается в виде минерала галита — каменной соли.
Слово «галит» происходит от греческого «галос», означающего и «соль», и «море». Гималайская розовая соль (Галит) — это чистейшая кристаллическая соль, образовавшаяся 250 миллионов лет назад, которая добывается в Гималаях и является абсолютно чистой от инородных примесей.
Соль — самая древняя приправа к еде, известная человеку. Без соли не обходится приготовление практически ни одного блюда. Соль делает еду не соленой, а вкусной. Но соль не только улучшает вкусовые качества еды, она просто жизненно необходима нам. Данное вещество не только способствует улучшению вкуса еды, но и благотворно влияет на функционирование человеческого организма. Без соли не могут существовать живые клетки. Соль используют для лечения нарушения обмена веществ, при заболеваниях сердца, почек, мочевого пузыря. В поваренную соль добавляют минеральное вещество йод, и получается йодированная соль. Ее используют для профилактики недостатка йода в организме, которое может привести к заболеваниям щитовидной железы. Соль содержится в таких продуктах, как, например, творог, сыр, хлеб, печенье или кукурузные хлопья. Ежедневное индивидуальное потребление соли составляет от – 0,5 г до 10—12 г. В организме взрослого человека содержится приблизительно 300 г соли.
1.3. Лечебные свойства соли.
Если соль в еде вы категорически отказываетесь использовать, то можно воспользоваться другими ее свойствами, например, целебными:
Компрессы из сухой или влажной соли уменьшают отечность. Для снятия отечности с ног хорошо помогают соляные ванночки. Соляные ванны полезны при нарушении функции щитовидной железы.
Компрессы из соляного раствора (1ч.л. на 1 литр воды) помогают избавиться от отёчности вокруг глаз.
Полоскание горла и ротовой полости раствором соли и соды не только помогает при воспалениях миндалин, но и освежает дыхание.
При раздражении кожи от укусов насекомых: смочите место укуса водой и посыпьте солью.
Многие люди любят принимать ванны с солью. Для ванн, как правило, используется морская соль. Такие процедуры хорошо очищают кожу и тонизируют ее. Морская соль хорошо влияет на нервную систему человека.
Людей, у которых есть такие заболевания как астма, бронхит, аллергия, лечат в соляных пещерах. Этот вид лечения называется – спелеотерапия. По сведениям раскопок спелеотерапия существовала ещё в древнем Риме.
1.4. Использование соли в хозяйстве.
Кроме приготовления пищи и лечения заболеваний соль может пригодиться в хозяйстве. В первую очередь это отличное чистящее средство. Смесь соли и скипидара избавят ванну или раковину от желтых пятен. Смесь соли и уксуса избавит руки от неприятного запаха после резки репчатого лука. Крепкий соляной раствор, слитый в раковину, предотвращает накопление жира на стенках водопроводных труб на кухне и избавляет от неприятного запаха.
Зимой на дорогах и тропинках образуется лёд, бывает гололедица. Чтобы люди не падали и не происходили аварии, лёд посыпают солью.
Очень широко люди используют соль при консервировании и солении пищевых продуктов: рыбы, мяса, овощей, грибов и т. д. Дело в том, что соль имеет уникальное свойство — убивать бактерии и микробы, которые вызывают гниение и порчу продуктов. На этом же свойстве основано производство мясных и рыбных консервов. Такие продукты очень долго не портятся, долго хранятся и могут применяться в пищу даже через несколько недель после их приготовления.
1.5. Кристаллы.
Наверное, все видели кристаллы воды — лёд. Узоры на окнах зимой – это тоже кристаллы воды. Что же такое кристаллы? Кристалл — это твердое состояние вещества. Он имеет определенную форму и определенное количество граней.[3] Кристаллы, в переводе с греческого языка, (krystallos) «лёд». Например, снежинки, морозные узоры на стеклах окон и иней, украшающий зимой голые ветки деревьев, представляют собой кристаллы льда, выросшие из паров воды. Многие кристаллы являются продуктами жизнедеятельности организмов. Некоторые виды моллюсков обладают способностью наращивать на инородных телах, попавших в раковину, перламутр. Через 5-10 лет образуется жемчуг. Кристаллами являются алмазы, рубины, сапфиры и другие драгоценные камни. За сутки в лаборатории можно вырастить кристалл каменной соли массой около килограмма. Кристаллы бывают разной формы. Иногда образуются дендриты — это кристаллы, похожие на веточки дерева; очень хрупкие, но очень красивые. Кристаллы могут иметь от четырех до нескольких сотен граней. Их цвет, блеск и форма затрагивали человеческое чувство прекрасного, и люди украшали ими себя и жилище
Кристаллы бывают различными по размерам. Многие из них можно увидеть только в микроскоп. Но встречаются гигантские кристаллы массой в несколько тонн.
Люди научились выращивать искусственные кристаллы — рубины. Используют их для изготовления ювелирных украшений и в часовых механизмах. Выращивают и самые твердые на свете кристаллы — алмазы. Мы же решили вырастить кристаллы поваренной и других солей в домашних условиях.
1.6. Опыты по выращиванию кристаллов.
После ознакомления с литературой и поиска информации в сети Интернет мы узнали, что существуют два простых способа выращивания кристаллов. [2]
1 способ — путем выпаривания.
2 способ — путем охлаждения насыщенного раствора .
Мы решили вырастить кристаллы из обычной поваренной соли, соли для ванн, медного купороса и железного купороса. (Приложение 2)
Первым способом, т.е путем выпаривания, выращивали кристаллы поваренной соли.
1. Приготовили дистиллированную воду (т.е. не содержащую примесей других солей). Для этого растопили снег и пропустили через фильтр, для того, чтобы в воде не содержались, посторонние предметы, такие как соринки. Если этого не сделать, то на эти соринки могут нарасти кристаллы и раствор станет ненасыщенным.
2.Растворили соль, из которой будет расти кристалл, в подогретой воде (подогреть нужно для того, чтобы соль растворилось немного больше, чем может раствориться в воде комнатной температуры). Растворяли соль до тех пор, пока не были уверены, что соль уже больше не растворяется (раствор насыщен!). На 100 граммов воды брали примерно 200-250 граммов соли. Для того, чтобы кристаллы выросли цветными, добавили красный и синий красители.
3. Насыщенный раствор профильтровали, для того, чтобы избавиться от осадка. Сразу же после этого опустили в раствор нитку, на которой будут образовываться кристаллики. Нить необходимо повесить так, чтобы она не касалась стенок стакана и дна.
4. Перенесли ёмкость с насыщенным раствором в теплое место (ближе к батарее), где нет сквозняков, вибрации (выращивание кристаллов требует соблюдение этих условий). Оставили раствор для дальнейшего наблюдения.
Наблюдения: через 5 дней на ниточке стали появляться первые кристаллы. Через неделю на стенках ёмкости стал появляться кристаллический налёт. Из–за испарения. Через 16 дней вода вся испарилась. На ниточках наросли мелкие кристаллы соли белого цвета. Опыт завершили.
Выводы по опыту: (Приложение 3)
Из раствора синего цвета выросли кристаллы белого цвета.
Из раствора красного цвета выросли кристаллы оранжевого цвета.
Кристаллы были мелкие, как песок.
Вторым способом, т.е путем охлаждения насыщенного раствора выращивали кристаллы из соли для ванн, медного купороса и железного купороса
Выращивание кристаллов из соли для ванн. Соль была сиреневого цвета.
1. Насыщенный раствор готовили тем же способом, что и в первом случае.
2.В раствор на нитке опустили «затравку» «(«затравка» — маленький кристаллик той же соли — кристаллов), так, чтобы он был погружен в раствор.
Стали наблюдать.
Наблюдения: Через 4 дня размер кристаллов вырос до 7 мм. За 2 недели кристалл увеличился до 1 см 3мм.
Выводы по опыту: (Приложение 4)
Рост кристалла путем охлаждения насыщенного раствора происходит быстрее, чем при испарении.
Отдельные кристаллы имеют кубическую форму.
Кристаллы выросли розового цвета.
Выращивание кристалла из медного купороса.
Внимание! Медный купорос — химически активная соль! Нужно помнить, что это вещество ядовито! Нужно тщательно мыть руки после работы с порошком, растворами или кристаллами медного купороса. Это химический реактив, поэтому работать с ними детям лучше под наблюдением взрослых.
1.Насыщенный раствор готовили тем же способом, что и в первом случае.
2. В раствор на нитке опустили «затравку».
3.Привязали на нитку гвоздик и опустили в раствор медного купороса. На наших глазах гвоздь моментально покрылся ржавчиной. Мы были очень удивлены!
Наблюдения:
Первые кристаллы стали появляться через 15 минут. Они были ярко голубого цвета. Через 30 минут кристалл был уже около 1 см. Через неделю кристалл перестал расти. На дне образовался осадок. Раствор стал не насыщенным. Тогда мы аккуратно вытащили кристалл из раствора.Раствор, в котором он рос, слили в другую ёмкость, поставили на плиту и добавили ещё медный купорос, сделав раствор опять насыщенным. Кристалл вернули на место. Уже через 25 минут стало заметно увеличение кристалла.
Выводы по опыту: (Приложение 5)
1. Кристаллы медного купороса растут быстро.
2. Имеют ярко голубой цвет.
3. Форма кристаллов имеет правильную форму. Четко просматриваются грани и рёбра кристалла.
Выращивание кристалла из железного купороса. Работая с ним необходимо помнить, что это вещество ядовито!
1.Приготовили насыщенный раствор.
2.Приготовили нить без затравки и металлический предмет.
3.Опустили в раствор.
Наблюдения:
Через 5 минут на них уже образовались первые кристаллы!Через 15 минут нить очень сильно обросла кристаллами. Через сутки кристалл вырос до 7 см. и перестал расти. Так как не было больше возможности приготовить опять насыщенный раствор (не было железного купороса), опыт решили остановить.
Выводы по опыту: (Приложение 6)
1. Кристаллы из железного купороса растут очень быстро.
2.Отдельные кристаллы выросли до 1 см.
3. Кристаллы из железного купороса имеют болотный цвет.
4. Форма кристаллов имеет правильную форму.
1.7. Выводы по результатам проведённых опытов:
1.Если выращивать кристаллы путём выпаривания, то кристаллы получаются мелкими.
2.Быстрее кристаллы растут тогда, когда в насыщенный раствор помещается кристалл «затравка».
3.Если раствор охлаждать медленно, то форма кристаллов будет правильной.
4. Необходимо раз в неделю делать раствор насыщенным.
5.Кристаллы капризны, требуют бережного к ним отношения.
6.При изменении условий выращивания, кристаллы разных солей имеют свою индивидуальную форму, цвет.
7. За 2- 3 недели можно вырастить кристаллы солей у себя дома.
8.Выращивание искусственных кристаллов очень увлекательный и интересный процесс.
Заключение:
Цель достигнута. Нам удалось вырастить кристаллы поваренной соли и других солей в домашних условиях. Выдвинутая гипотеза в ходе проведения опытов и наблюдений была подтверждена. Действительно, кристаллы разных солей имеют свою форму и цвет.
Кроме того, нам очень понравился процесс выращивания кристаллов – это очень увлекательное занятие. У нас появилось желание украсить «зимний букет» выращенными кристаллами. Вот так любой человек в домашних условиях может подарить близким «чудо». (Приложение 7)
Литература:
1.Круглов Ю. Г. «Русские народные загадки, пословицы, поговорки». Москва. Просвящение 1990 г.
2.Ольгин О., «Опыты без взрывов», М.; «Химия», 1995г
3. http://potomy.ru/world/1059.html
4 http://www.allskazki.ru/rus/159.html
Приложение 1
Пословицы о соли.
Без соли не вкусно, без хлеба не сытно.
Без соли и хлеб не естся.
Без соли и стол кривой
Без соли, без хлеба — худа беседа
Соли не жалей, так и есть веселей
Пуд соли вместе съесть.
От хлеба-соли и царь не отказывается.
Недосол на столе, пересол на спине.
Без хлеба, без соли никто не обедает.
В начале и в конце обеда, для счастья, съешь кусочек хлеба с солью.
Хлеб да соль и обед пошел.
Так солоно, что в пот бросает.
Приложение 2
Соли, из которых выращивали кристаллы:


Поваренная соль. Соль для ванн.


Железный купорос. Медный купорос.
Приложение 3
Выращенные кристаллы из поваренной соли.


Приложение 4
Выращенные кристаллы из соли для ванн.
. 
Приложение 5
Выращенные кристаллы из медного купороса.

Приложение 6
Выращенные кристаллы из железного купороса.

Приложение 7
Результат нашей работы радует!!!






Leave a Reply